Enzim
Dari Wikipedia bahasa Indonesia, ensiklopedia bebas
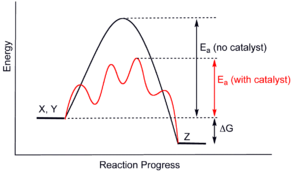
Diagram energi potensial reaksi kimia organik yang menunjukkan efek katalis pada suatu reaksi eksotermik hipotetis X + Y = Z.
Enzim adalah
biomolekul berupa
protein yang berfungsi sebagai
katalis (senyawa yang mempercepat proses reaksi tanpa habis bereaksi) dalam suatu
reaksi kimia organik.
[1][2] Molekul awal yang disebut
substrat akan dipercepat perubahannya menjadi molekul lain yang disebut produk. Jenis produk yang akan dihasilkan bergantung pada suatu kondisi/zat, yang disebut
promoter. Semua proses biologis
sel memerlukan enzim agar dapat berlangsung dengan cukup cepat dalam suatu arah
lintasan metabolisme yang ditentukan oleh
hormon sebagai promoter.
Enzim bekerja dengan cara bereaksi dengan molekul substrat untuk menghasilkan senyawa
intermediat melalui suatu reaksi kimia organik yang membutuhkan
energi aktivasi lebih rendah, sehingga percepatan reaksi kimia terjadi karena reaksi kimia dengan energi aktivasi lebih tinggi membutuhkan waktu lebih lama. Sebagai contoh:
- X + C → XC (1)
- Y + XC → XYC (2)
- XYC → CZ (3)
- CZ → C + Z (4)
Meskipun senyawa katalis dapat berubah pada reaksi awal, pada reaksi akhir molekul katalis akan kembali ke bentuk semula.
Sebagian besar enzim bekerja secara khas, yang artinya setiap jenis enzim hanya dapat bekerja pada satu macam
senyawa atau
reaksi kimia. Hal ini disebabkan perbedaan
struktur kimia tiap enzim yang bersifat tetap. Sebagai contoh, enzim
α-amilase hanya dapat digunakan pada proses perombakan
pati menjadi
glukosa.
Kerja enzim dipengaruhi oleh beberapa faktor, terutama adalah
substrat,
suhu,
keasaman,
kofaktor dan
inhibitor. Tiap enzim memerlukan suhu dan
pH (tingkat keasaman) optimum yang berbeda-beda karena enzim adalah
protein, yang dapat mengalami perubahan bentuk jika suhu dan keasaman berubah. Di luar suhu atau pH yang sesuai, enzim tidak dapat bekerja secara
optimal atau strukturnya akan mengalami kerusakan. Hal ini akan menyebabkan enzim kehilangan fungsinya sama sekali. Kerja enzim juga dipengaruhi oleh molekul lain.
Inhibitor adalah molekul yang menurunkan aktivitas enzim, sedangkan
aktivator adalah yang meningkatkan aktivitas enzim. Banyak
obat dan
racun adalah inihibitor enzim.
[sunting] Etimologi dan Sejarah
Hal-ihwal yang berkaitan dengan enzim dipelajari dalam
enzimologi. Dalam dunia pendidikan tinggi, enzimologi tidak dipelajari tersendiri sebagai satu jurusan tersendiri tetapi sejumlah program studi memberikan mata kuliah ini. Enzimologi terutama dipelajari dalam
kedokteran,
ilmu pangan, teknologi pengolahan pangan, dan cabang-cabang ilmu
pertanian.
Pada akhir tahun 1700-an dan awal tahun 1800-an, pencernaan
daging oleh sekresi perut
[3] dan konversi
pati menjadi
gula oleh ekstrak tumbuhan dan
ludah telah diketahui. Namun, mekanisme bagaimana hal ini terjadi belum diidentifikasi.
[4]
Pada abad ke-19, ketika mengkaji
fermentasi gula menjadi
alkohol oleh
ragi,
Louis Pasteur menyimpulkan bahwa fermentasi ini dikatalisasi oleh gaya dorong vital yang terdapat dalam sel ragi, disebut sebagai "
ferment", dan diperkirakan hanya berfungsi dalam tubuh organisme hidup. Ia menulis bahwa "fermentasi alkoholik adalah peristiwa yang berhubungan dengan kehidupan dan organisasi sel ragi, dan bukannya kematian ataupun putrefaksi sel tersebut."
[5]
Pada tahun 1878, ahli fisiologi Jerman
Wilhelm Kühne (1837–1900) pertama kali menggunakan istilah "
enzyme", yang berasal dari
bahasa Yunani ενζυμον yang berarti "dalam bahan pengembang" (ragi), untuk menjelaskan proses ini. Kata "
enzyme" kemudian digunakan untuk merujuk pada zat mati seperti
pepsin, dan kata
ferment digunakan untuk merujuk pada aktivitas kimiawi yang dihasilkan oleh organisme hidup.
Pada tahun 1897,
Eduard Buchner memulai kajiannya mengenai kemampuan ekstrak ragi untuk memfermentasi gula walaupun ia tidak terdapat pada sel ragi yang hidup. Pada sederet eksperimen di
Universitas Berlin, ia menemukan bahwa gula difermentasi bahkan apabila sel ragi tidak terdapat pada campuran.
[6] Ia menamai enzim yang memfermentasi sukrosa sebagai "
zymase" (
zimase).
[7] Pada tahun 1907, ia menerima
penghargaan Nobel dalam bidang
kimia "atas riset biokimia dan penemuan fermentasi tanpa sel yang dilakukannya". Mengikuti praktek Buchner, enzim biasanya dinamai sesuai dengan reaksi yang dikatalisasi oleh enzim tersebut. Umumnya, untuk mendapatkan nama sebuah enzim, akhiran
-ase ditambahkan pada nama
substrat enzim tersebut (contohnya:
laktase, merupakan enzim yang mengurai
laktosa) ataupun pada jenis reaksi yang dikatalisasi (contoh:
DNA polimerase yang menghasilkan polimer DNA).
Penemuan bahwa enzim dapat bekerja diluar sel hidup mendorong penelitian pada sifat-sifat biokimia enzim tersebut. Banyak peneliti awal menemukan bahwa aktivitas enzim diasosiasikan dengan protein, namun beberapa ilmuwan seperti
Richard Willstätter berargumen bahwa proten hanyalah bertindak sebagai pembawa enzim dan protein sendiri tidak dapat melakukan katalisis. Namun, pada tahun 1926,
James B. Sumner berhasil mengkristalisasi enzim
urease dan menunjukkan bahwa ia merupakan protein murni. Kesimpulannya adalah bahwa protein murni dapat berupa enzim dan hal ini secara tuntas dibuktikan oleh
Northrop dan
Stanley yang meneliti enzim pencernaan pepsin (1930), tripsin, dan kimotripsin. Ketiga ilmuwan ini meraih penghargaan Nobel tahun 1946 pada bidang kimia.
[8]
Penemuan bahwa enzim dapat dikristalisasi pada akhirnya mengijinkan struktur enzim ditentukan melalui
kristalografi sinar-X. Metode ini pertama kali diterapkan pada
lisozim, enzim yang ditemukan pada air mata, air ludah, dan telur putih, yang mencerna lapisan pelindung beberapa bakteri. Struktur enzim ini dipecahkan oleh sekelompok ilmuwan yang diketuai oleh
David Chilton Phillips dan dipublikasikan pada tahun 1965.
[9] Struktur lisozim dalam resolusi tinggi ini menandai dimulainya bidang
biologi struktural dan usaha untuk memahami bagaimana enzim bekerja pada tingkat atom.
[sunting] Konvensi penamaan
Nama enzim sering kali diturunkan dari nama substrat ataupun reaksi kimia yang ia kataliskan dengan akhiran
-ase. Contohnya adalah
laktase,
alkohol dehidrogenase (mengatalisis penghilangan hidrogen dari alkohol), dan
DNA polimerase.
International Union of Biochemistry and Molecular Biology telah mengembangkan suatu tatanama untuk enzim, yang disebut sebagai
nomor EC; tiap-tiap enzim memiliki empat digit nomor urut sesuai dengan ketentuan klasifikasi yang berlaku. Nomor pertama untuk klasifikasi teratas enzim didasarkan pada ketentuan berikut:
Tata nama secara lengkap dapat dilihat di
http://www.chem.qmul.ac.uk/iubmb/enzyme/ (Bahasa Inggris).
[sunting] Struktur dan mekanisme
Enzim umumnya merupakan
protein globular dan ukurannya berkisar dari hanya 62 asam amino pada
monomer 4-oksalokrotonat tautomerase[10], sampai dengan lebih dari 2.500 residu pada
asam lemak sintase.
[11] Terdapat pula sejumlah kecil katalis RNA, dengan yang paling umum merupakan
ribosom; Jenis enzim ini dirujuk sebagai RNA-enzim ataupun
ribozim. Aktivitas enzim ditentukan oleh struktur tiga dimensinya (struktur kuaterner).
[12] Walaupun struktur enzim menentukan fungsinya, prediksi aktivitas enzim baru yang hanya dilihat dari strukturnya adalah hal yang sangat sulit.
[13]
Kebanyakan enzim berukuran lebih besar daripada substratnya, tetapi hanya sebagian kecil asam amino enzim (sekitar 3–4
asam amino) yang secara langsung terlibat dalam katalisis.
[14] Daerah yang mengandung residu katalitik yang akan mengikat substrat dan kemudian menjalani reaksi ini dikenal sebagai
tapak aktif. Enzim juga dapat mengandung tapak yang mengikat
kofaktor yang diperlukan untuk katalisis. Beberapa enzim juga memiliki tapak ikat untuk molekul kecil, yang sering kali merupakan produk langsung ataupun tak langsung dari reaksi yang dikatalisasi. Pengikatan ini dapat meningkatkan ataupun menurunkan aktivitas enzim. Dengan demikian ia berfungsi sebagai regulasi
umpan balik.
Sama seperti protein-protein lainnya, enzim merupakan rantai asam amino yang
melipat. Tiap-tiap urutan asam amino menghasilkan struktur pelipatan dan sifat-sifat kimiawi yang khas. Rantai protein tunggal kadang-kadang dapat berkumpul bersama dan membentuk
kompleks protein. Kebanyakan enzim dapat mengalami
denaturasi (yakni terbuka dari lipatannya dan menjadi tidak aktif) oleh pemanasan ataupun denaturan kimiawi. Tergantung pada jenis-jenis enzim, denaturasi dapat bersifat reversibel maupun ireversibel.
[sunting] Kespesifikan
Enzim biasanya sangat spesifik terhadap reaksi yang ia kataliskan maupun terhadap
substrat yang terlibat dalam reaksi. Bentuk, muatan dan katakteristik
hidrofilik/
hidrofobik enzim dan substrat bertanggung jawab terhadap kespesifikan ini. Enzim juga dapat menunjukkan tingkat
stereospesifisitas,
regioselektivitas, dan
kemoselektivitas yang sangat tinggi.
[15]
Beberapa enzim yang menunjukkan akurasi dan kespesifikan tertinggi terlibat dalam pengkopian dan
pengekspresian genom. Enzim-enzim ini memiliki mekanisme "sistem pengecekan ulang". Enzim seperti
DNA polimerase mengatalisasi reaksi pada langkah pertama dan mengecek apakah produk reaksinya benar pada langkah kedua.
[16] Proses dwi-langkah ini menurunkan laju kesalahan dengan 1 kesalahan untuk setiap 100 juta reaksi pada polimerase
mamalia.
[17] Mekanisme yang sama juga dapat ditemukan pada
RNA polimerase,
[18] aminoasil tRNA sintetase[19] dan
ribosom.
[20]
Beberapa enzim yang menghasilkan
metabolit sekunder dikatakan sebagai "tidak pilih-pilih", yakni bahwa ia dapat bekerja pada berbagai jenis substrat yang berbeda-beda. Diajukan bahwa kespesifikan substrat yang sangat luas ini sangat penting terhadap evolusi lintasan biosintetik yang baru.
[21]
[sunting] Model "kunci dan gembok"
Enzim sangatlah spesifik. Pada tahun 1894,
Emil Fischer mengajukan bahwa hal ini dikarenakan baik enzim dan substrat memiliki bentuk geometri yang saling memenuhi.
[22] Hal ini sering dirujuk sebagai model "Kunci dan Gembok". Manakala model ini menjelaskan kespesifikan enzim, ia gagal dalam menjelaskan stabilisasi keadaan transisi yang dicapai oleh enzim. Model ini telah dibuktikan tidak akurat, dan model ketepatan induksilah yang sekarang paling banyak diterima.
[sunting] Model ketepatan induksi

Diagram yang menggambarkan hipotesis ketepatan induksi.
Pada tahun 1958,
Daniel Koshland mengajukan modifikasi model kunci dan gembok: oleh karena enzim memiliki struktur yang fleksibel, tapak aktif secara terus menerus berubah bentuknya sesuai dengan interaksi antara enzim dan substrat.
[23] Akibatnya, substrat tidak berikatan dengan tapak aktif yang kaku. Orientasi
rantai samping asam amino berubah sesuai dengan substrat dan mengijinkan enzim untuk menjalankan fungsi katalitiknya. Pada beberapa kasus, misalnya glikosidase, molekul substrat juga berubah sedikit ketika ia memasuki tapak aktif.
[24] Tapak aktif akan terus berubah bentuknya sampai substrat terikat secara sepenuhnya, yang mana bentuk akhir dan muatan enzim ditentukan.
[25]
Enzim dapat bekerja dengan beberapa cara, yang kesemuaannya menurunkan ΔG
‡:
[26]
- Menurunkan energi aktivasi dengan menciptakan suatu lingkungan yang mana keadaan transisi terstabilisasi (contohnya mengubah bentuk substrat menjadi konformasi keadaan transisi ketika ia terikat dengan enzim.)
- Menurunkan energi keadaan transisi tanpa mengubah bentuk substrat dengan menciptakan lingkungan yang memiliki distribusi muatan yang berlawanan dengan keadaan transisi.
- Menyediakan lintasan reaksi alternatif. Contohnya bereaksi dengan substrat sementara waktu untuk membentuk kompleks Enzim-Substrat antara.
- Menurunkan perubahan entropi reaksi dengan menggiring substrat bersama pada orientasi yang tepat untuk bereaksi. Menariknya, efek entropi ini melibatkan destabilisasi keadaan dasar,[27] dan kontribusinya terhadap katalis relatif kecil.[28]
[sunting] Stabilisasi keadaan transisi
Pemahaman asal usul penurunan ΔG
‡ memerlukan pengetahuan bagaimana enzim dapat menghasilkan keadaan transisi reaksi yang lebih stabil dibandingkan dengan stabilitas keadaan transisi reaksi tanpa katalis. Cara yang paling efektif untuk mencapai stabilisasi yang besar adalah menggunakan efek elektrostatik, terutama pada lingkungan yang relatif polar yang diorientasikan ke distribusi muatan keadaan transisi.
[29] Lingkungan seperti ini tidak ada dapat ditemukan pada reaksi tanpa katalis di air.
[sunting] Dinamika dan fungsi
Dinamika internal enzim berhubungan dengan mekanisme katalis enzim tersebut.
[30][31][32] Dinamika internal enzim adalah pergerakan bahagian struktur enzim, misalnya residu asam amino tunggal, sekelompok asam amino, ataupun bahwa keseluruhan
domain protein. Pergerakan ini terjadi pada skala waktu yang bervariasi, berkisar dari beberapa femtodetik sampai dengan beberapa detik. Jaringan residu protein di seluruh struktur enzim dapat berkontribusi terhadap katalisis melalui gerak dinamik.
[33][34][35][36] Gerakan protein sangat vital, namun apakah vibrasi yang cepat atau lambat maupun pergerakan konformasi yang besar atau kecil yang lebih penting bergantung pada tipe reaksi yang terlibat. Namun, walaupun gerak ini sangat penting dalam hal pengikatan dan pelepasan substrat dan produk, adalah tidak jelas jika gerak ini membantu mempercepat langkah-langkah reaksi reaksi enzimatik ini.
[37] Penyingkapan ini juga memiliki implikasi yang luas dalam pemahaman efek alosterik dan pengembangan obat baru.
[sunting] Modulasi alosterik
Enzim
alosterik mengubah strukturnya sesuai dengan
efektornya. Modulasi ini dapat terjadi secara langsung, di mana efektor mengikat
tapak ikat enzim secara lngsung, ataupun secara tidak langsung, di mana efektor mengikat protein atau
subunit protein lain yang berinteraksi dengan enzim alosterik, sehingga memengaruhi aktivitas katalitiknya.
[sunting] Kofaktor dan koenzim
Beberapa enzim tidak memerlukan komponen tambahan untuk mencapai aktivitas penuhnya. Namun beberapa memerlukan pula molekul non-protein yang disebut kofaktor untuk berikatan dengan enzim dan menjadi aktif.
[38] Kofaktor dapat berupa zat
anorganik (contohnya ion logam) ataupun zat
organik (contohnya
flavin dan
heme). Kofaktor dapat berupa
gugus prostetik yang mengikat dengan kuat, ataupun
koenzim, yang akan melepaskan diri dari tapak aktif enzim semasa reaksi.
Enzim yang memerlukan kofaktor namun tidak terdapat kofaktor yang terikat dengannya disebut sebagai
apoenzim ataupun
apoprotein. Apoenzim beserta dengan kofaktornya disebut
holoenzim (bentuk aktif). Kebanyakan kofaktor tidak terikat secara kovalen dengan enzim, tetapi terikat dengan kuat. Namun, gugus prostetik organik dapat pula terikat secara kovalen (contohnya
tiamina pirofosfat pada enzim
piruvat dehidrogenase). Istilah
holoenzim juga dapat digunakan untuk merujuk pada enzim yang mengandung subunit protein berganda, seperti
DNA polimerase. Pada kasus ini, holoenzim adalah kompleks lengkap yang mengandung seluruh subunit yang diperlukan agar menjadi aktif.
Contoh enzim yang mengandung kofaktor adalah
karbonat anhidrase, dengan kofaktor
seng terikat sebagai bagian dari tapak aktifnya.
[39]

Model pengisian ruang koenzim NADH
Koenzim adalah kofaktor berupa molekul organik kecil yang mentranspor gugus kimia atau elektron dari satu enzim ke enzim lainnya.
[38][40][41] Contoh koenzim mencakup
NADH,
NADPH dan
adenosina trifosfat. Gugus kimiawi yang dibawa mencakup ion
hidrida (H
–) yang dibawa oleh
NAD atau NADP+, gugus asetil yang dibawa oleh
koenzim A, formil, metenil, ataupun gugus metil yang dibawa oleh
asam folat, dan gugus metil yang dibawa oleh
S-adenosilmetionina. Beberapa koenzim seperti
riboflavin,
tiamina, dan
asam folat adalah
vitamin.
Oleh karena koenzim secara kimiawi berubah oleh aksi enzim, adalah dapat dikatakan koenzim merupakan substrat yang khusus, ataupun substrat sekunder. Sebagai contoh, sekitar 700 enzim diketahui menggunakan koenzim NADH.
[42]
Regenerasi serta pemeliharaan konsentrasi koenzim terjadi dalam sel. Contohnya, NADPH diregenerasi melalui lintasan pentosa fosfat, dan
S-adenosilmetionina melalui metionina adenosiltransferase.
[sunting] Termodinamika

Tahapan-tahapan energi pada
reaksi kimia. Substrat memerlukan energi yang banyak untuk mencapai
keadaan transisi, yang akan kemudian berubah menjadi produk. Enzim menstabilisasi keadaan transisi, menurunkan energi yang diperlukan untuk menjadi produk.
Sebagai katalis, enzim tidak mengubah posisi kesetimbangan reaksi kimia. Biasanya reaksi akan berjalan ke arah yang sama dengan reaksi tanpa katalis. Perbedaannya adalah, reaksi enzimatik berjalan lebih cepat. Namun, tanpa keberadaan enzim, reaksi samping yang memungkinkan dapat terjadi dan menghasilkan produk yang berbeda.
Lebih lanjut, enzim dapat menggabungkan dua atau lebih reaksi, sehingga reaksi yang difavoritkan secara termodinamik dapat digunakan untuk mendorong reaksi yang tidak difavoritkan secara termodinamik. Sebagai contoh, hidrolsis
ATP sering kali menggunakan reaksi kimia lainnya untuk mendorong reaksi.
Enzim mengatalisasi reaksi maju dan balik secara seimbang. Enzim tidak mengubah kesetimbangan reaksi itu sendiri, namun hanya mempercepat reaksi saja. Sebagai contoh,
karbonat anhidrase mengatalisasi reaksinya ke dua arah bergantung pada konsentrasi reaktan.
 (dalam jaringan tubuh; konsentrasi CO2 yang tinggi)
(dalam jaringan tubuh; konsentrasi CO2 yang tinggi) (pada paru-paru; konsentrasi CO2 yang rendah)
(pada paru-paru; konsentrasi CO2 yang rendah)
Walaupun demikian, jika kesetimbangan tersebut sangat memfavoritkan satu arah reaksi, yakni reaksi yang sangat
eksergonik, reaksi itu akan menjadi ireversible. Pada kondisi demikian, enzim akan hanya mengatalisasi reaksi yang diijinkan secara termodinamik.

Mekanisme reaksi enzimatik untuk sebuah subtrat tunggal. Enzim (E) mengikat substrat (S) dan menghasilkan produk (P).
Kinetika enzim menginvestigasi bagaimana enzim mengikat substrat dengan mengubahnya menjadi produk. Data laju yang digunakan dalam analisis kinetika didapatkan dari
asai enzim.
Pada tahun 1902, Victor Henri
[43] mengajukan suatu teori kinetika enzim yang kuantitatif, namun data eksperimennya tidak berguna karena perhatian pada konsentrasi ion hidrogen pada saat itu masih belum dititikberatkan. Setelah
Peter Lauritz Sørensen menentukan skala pH logaritmik dan memperkenalkan konsep penyanggaan (
buffering) pada tahun 1909
[44], kimiawan Jerman
Leonor Michaelis dan murid bimbingan pascadokotoralnya yang berasal dari Kanada,
Maud Leonora Menten, mengulangi eksperimen Henri dan mengkonfirmasi persamaan Henri. Persamaan ini kemudian dikenal dengan nama
Kinetika Henri-Michaelis-Menten (kadang-kadang juga hanya disebut kinetika Michaelis-Menten).
[45] Hasil kerja mereka kemudian dikembangkan lebih jauh oleh
G. E. Briggs dan
J. B. S. Haldane. Penurunan persamaan kinetika yang diturunkan mereka masih digunakan secara meluas sampai sekarang .
[46]
Salah satu kontribusi utama Henri pada kinetika enzim adalah memandang reaksi enzim sebagai dua tahapan. Pada tahap pertama, subtrat terikat ke enzim secara reversible, membentuk kompleks enzim-substrat. Kompleks ini kadang-kadang disebut sebagai kompleks Michaelis. Enzim kemudian mengatalisasi reaksi kimia dan melepaskan produk.

Kurva kejenuhan suatu reaksi enzim yang menunjukkan relasi antara konsentrasi substrat (S) dengan kelajuan (
v).
Enzim dapat mengatalisasi reaksi dengan kelajuan mencapai jutaan reaksi per detik. Sebagai contoh, tanpa keberadaan enzim, reaksi yang dikatalisasi oleh enzim
orotidina 5'-fosfat dekarboksilase akan memerlukan waktu 78 juta tahun untuk mengubah 50% substrat menjadi produk. Namun, apabila enzim tersebut ditambahkan, proses ini hanya memerlukan waktu 25 milidetik.
[47] Laju reaksi bergantung pada kondisi larutan dan konsentrasi substrat. Kondisi-kondisi yang menyebabkan denaturasi protein seperti temperatur tinggi, konsentrasi garam yang tinggi, dan nilai pH yang terlalu tinggi atau terlalu rendah akan menghilangkan aktivitas enzim. Sedangkan peningkatan konsentrasi substrat cenderung meningkatkan aktivitasnya. Untuk menentukan kelajuan maksimum suatu reaksi enzimatik, konsentrasi substrat ditingkatkan sampai laju pembentukan produk yang terpantau menjadi konstan. Hal ini ditunjukkan oleh kurva kejenuhan di samping. Kejenuhan terjadi karena seiring dengan meningkatnya konsentrasi substrat, semakin banyak enzim bebas yang diubah menjadi kompleks substrate-enzim ES. Pada kelajuan yang maksimum (
Vmax), semua tapak aktif enzim akan berikatan dengan substrat, dan jumlah kompleks ES adalah sama dengan jumlah total enzim yang ada. Namun,
Vmax hanyalah salah satu konstanta kinetika enzim. Jumlah substrat yang diperlukan untuk mencapai nilai kelajuan reaksi tertentu jugalah penting. Hal ini diekspresikan oleh
konstanta Michaelis-Menten (
Km), yang merupakan konsentrasi substrat yang diperlukan oleh suatu enzim untuk mencapai setengah kelajuan maksimumnya. Setiap enzim memiliki nilai
Km yang berbeda-beda untuk suatu subtrat, dan ini dapat menunjukkan seberapa kuatnya pengikatan substrat ke enzim. Konstanta lainnya yang juga berguna adalah
kcat, yang merupakan jumlah molekul substrat yang dapat ditangani oleh satu tapak aktif per detik.
Efisiensi suatu enzim diekspresikan oleh
kcat/
Km. Ia juga disebut sebagai konstanta kespesifikan dan memasukkan
tetapan kelajuan semua langkah reaksi. Karena konstanta kespesifikan mencermikan kemampuan katalitik dan afinitas, ia dapat digunakan untuk membandingkan enzim yang satu dengan enzim yang lain, ataupun enzim yang sama dengan substrat yang berbeda. Konstanta kespesifikan maksimum teoritis disebut limit difusi dan nilainya sekitar 10
8 sampai 10
9 (M
-1 s
-1). Pada titik ini, setiap penumbukkan enzim dengan substratnya akan menyebabkan katalisis, dan laju pembentukan produk tidak dibatasi oleh laju reaksi, melainkan oleh laju difusi. Enzim dengan sifat demikian disebut
secara katalitik sempurna ataupun
secara kinetika sempurna. Contoh enzim yang memiliki sifat seperti ini adalah
karbonat anhidrase,
asetilkolinesterase,
katalase, fumarase, β-laktamase, dan
superoksida dismutase.
Kinetika Michaelis-Menten bergantung pada
hukum aksi massa, yang diturunkan berdasarkan asumsi
difusi bebas dan pertumbukan acak yang didorong secara termodinamik. Namun, banyak proses-proses biokimia dan selular yang menyimpang dari kondisi ideal ini, disebabkan oleh kesesakan makromolekuler (
macromolecular crowding), perpisahan fase enzim/substrat/produk, dan pergerakan molekul secara satu atau dua dimensi.
[48] Pada situasi seperti ini,
kinetika Michaelis-Menten fraktal dapat diterapkan.
[49][50][51][52]
Beberapa enzim beroperasi dengan kinetika yang lebih cepat daripada laju difusi. Hal ini tampaknya sangat tidak mungkin. Beberapa mekanisme telah diajukan untuk menjelaskan fenomena ini. Beberapa protein dipercayai mempercepat katalisis dengan menarik substratnya dan melakukan pra-orientasi substrat menggunakan medan listrik dipolar. Model lainnya menggunakan penjelasan penerowongan kuantum mekanika, walaupun penjelasan ini masih kontroversial.
[53][54] Penerowongan kuantum untuk proton telah terpantau pada
triptamina.
[55]

Inhibitor kompetitif mengikat enzim secara reversibel, menghalangi pengikatan substrat. Di lain pihak, pengikatn substrat juga menghalangi pengikatan inhibitor. Substrat dan inhibitor berkompetisi satu sama lainnya.
Laju reaksi enzim dapat diturunkan menggunakan berbagai jenis
inhibitor enzim.
- Inhibisi kompetitif
Pada inihibisi kompetitif, inhibitor dan substrat berkompetisi untuk berikatan dengan enzim. Seringkali inhibitor kompetitif memiliki struktur yang sangat mirip dengan substrat asli enzim. Sebagai contoh,
metotreksat adalah inihibitor kompetitif untuk enzim
dihidrofolat reduktase. Kemiripan antara struktur asam folat dengan obat ini ditunjukkan oleh gambar di samping bawah. Perhatikan bahwa pengikatan inhibitor tidaklah perlu terjadi pada tapak pengikatan substrat apabila pengikatan inihibitor mengubah konformasi enzim, sehingga menghalangi pengikatan substrat. Pada inhibisi kompetitif, kelajuan maksimal reaksi tidak berubah, namun memerlukan konsentrasi substrat yang lebih tinggi untuk mencapai kelajuan maksimal tersebut, sehingga meningkatkan K
m.
- Inhibisi tak kompetitif
Pada inhibisi tak kompetitif, inhibitor tidak dapat berikatan dengan enzim bebas, namun hanya dapat dengan komples ES. Kompleks EIS yang terbentuk kemudian menjadi tidak aktif. Jenis inhibisi ini sangat jarang, namun dapat terjadi pada enzim-enzim multimerik.
- Inhibisi non-kompetitif
Inhibitor non-kompetitif dapat mengikat enzim pada saat yang sama substrat berikatan dengan enzim. Baik kompleks EI dan EIS tidak aktif. Karena inhibitor tidak dapat dilawan dengan peningkatan konsentrasi substrat, V
max reaksi berubah. Namun, karena substrat masih dapat mengikat enzim, K
m tetaplah sama.
- Inhibisi campuran
Inhibisis jenis ini mirip dengan inhibisi non-kompetitif, kecuali kompleks EIS memiliki aktivitas enzimatik residual.
Pada banyak organisme, inhibitor dapat merupakan bagian dari mekanisme
umpan balik. Jika enzim memproduksi terlalu banyak produk, produk tersebut dapat berperan sebagai inhibitor bagi enzim tersebut. Hal ini akan menyebabkan produksi produk melambat atau berhenti. Bentuk umpan balik ini adalah umpan balik negatif. Enzim memiliki bentuk regulasi seperti ini sering kali multimerik dan mempunyai tapak ikat alosterik. Kurva substrat/kelajuan enzim ini tidak berbentuk hiperbola melainkan berbentuk S.
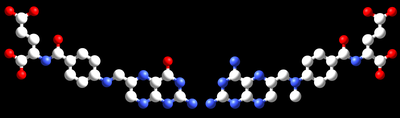
Koenzim asam folat (kiri) dan obat anti kanker metotreksat (kanan) memiliki struktur yang sangat mirip. Oleh sebab itu, metotreksat adalah inhibitor kompetitif bagi enzim yang menggunukan folat.
Inhibitor ireversibel bereaksi dengan enzim dan membentuk aduk dengan protein. Inaktivasi ini bersifat ireversible. Inhibitor seperti ini contohnya
efloritina, obat yang digunakan untuk mengobati penyakit yang disebabkan oleh protozoa
African trypanosomiasis.
[57] Penisilin dan
Aspirin juga bekerja dengan cara yang sama. Senyawa obat ini terikat pada tapak aktif, dan enzim kemudian mengubah inhibitor menjadi bentuk aktif yang bereaksi secara ireversibel dengan satu atau lebih residu asam amino.
- Kegunaan inhibitor
Oleh karena inhibitor menghambat fungsi enzim, inhibitor sering digunakan sebagai obat. Contohnya adalah inhibitor yang digunakan sebagai obat
aspirin. Aspirin menginhibisi enzim
COX-1 dan
COX-2 yang memproduksi pembawa pesan peradangan
prostaglandin, sehingga ia dapat menekan peradangan dan rasa sakit. Namun, banyak pula inhibitor enzim lainnya yang beracun. Sebagai contohnya,
sianida yang merupakan inhibitor enzim ireversibel, akan bergabung dengan tembaga dan besi pada tapak aktif enzim
sitokrom c oksidase dan memblok
pernapasan sel.
[58]
[sunting] Fungsi biologis
Enzim mempunyai berbagai fungsi bioligis dalam tubuh organisme hidup. Enzim berperan dalam
transduksi signal dan regulasi sel, seringkali melalui enzim
kinase dan
fosfatase.
[59] Enzim juga berperan dalam menghasilkan pergerakan tubuh, dengan
miosin menghidrolisis ATP untuk menghasilkan
kontraksi otot.
[60] ATPase lainnya dalam membran sel umumnya adalah
pompa ion yang terlibat dalam
transpor aktif. Enzim juga terlibat dalam fungs-fungsi yang khas, seperti
lusiferase yang menghasilkan cahaya pada
kunang-kunang.
[61] Virus juga mengandung enzim yang dapat menyerang sel, misalnya
HIV integrase dan
transkriptase balik.
Salah satu fungsi penting enzim adalah pada
sistem pencernaan hewan. Enzim seperti
amilase dan
protease memecah molekul yang besar (seperti
pati dan
protein) menjadi molekul yang kecil, sehingga dapat diserap oleh usus. Molekul pati, sebagai contohnya, terlalu besar untuk diserap oleh usus, namun enzim akan menghidrolisis rantai pati menjadi molekul kecil seperti
maltosa, yang akan dihidrolisis lebih jauh menjadi
glukosa, sehingga dapat diserap. Enzim-enzim yang berbeda, mencerna zat-zat makanan yang berbeda pula. Pada
hewan pemamah biak, mikroorganisme dalam perut hewan tersebut menghasilkan enzim
selulase yang dapat mengurai sel dinding selulosa tanaman.
[62]
Beberapa enzim dapat bekerja bersama dalam urutan tertentu, dan menghasilan
lintasan metabolisme. Dalam lintasan metabolisme, satu enzim akan membawa produk enzim lainnya sebagai substrat. Setelah reaksi katalitik terjadi, produk kemudian dihantarkan ke enzim lainnya. Kadang-kadang lebih dari satu enzim dapat mengatalisasi reaksi yang sama secara bersamaan.
Enzim menentukan langkah-langkah apa saja yang terjadi dalam lintasan metabolisme ini. Tanpa enzim, metabolisme tidak akan berjalan melalui langkah yang teratur ataupun tidak akan berjalan dengan cukup cepat untuk memenuhi kebutuhan sel. Dan sebenarnya, lintasan metabolisme seperti
glikolisis tidak akan dapat terjadi tanpa enzim. Glukosa, contohnya, dapat bereaksi secara langsung dengan ATP, dan menjadi ter
fosforliasi pada karbon-karbonnya secara acak. Tanpa keberadaan enzim, proses ini berjalan dengan sangat lambat. Namun, jika
heksokinase ditambahkan, reaksi ini tetap berjalan, namun fosforilasi pada karbon 6 akan terjadi dengan sangat cepat, sedemikiannya produk
glukosa-6-fosfat ditemukan sebagai produk utama. Oleh karena itu, jaringan lintasan metabolisme dalam tiap-tiap sel bergantung pada kumpulan enzim fungsional yang terdapat dalam sel tersebut.
[sunting] Kontrol aktivitas
Terdapat lima cara utama aktivitas enzim dikontrol dalam sel.
- Produksi enzim (transkripsi dan translasi gen enzim) dapat ditingkatkan atau diturunkan bergantung pada respon sel terhadap perubahan lingkungan. Bentuk regulase gen ini disebut induksi dan inhibisi enzim. Sebagai contohnya, bakteri dapat menjadi resistan terhadap antibiotik seperti penisilin karena enzim yang disebut beta-laktamase menginduksi hidrolisis cincin beta-laktam penisilin. Contoh lainnya adalah enzim dalam hati yang disebut sitokrom P450 oksidase yang penting dalam metabolisme obat. Induksi atau inhibisi enzim ini dapat mengakibatkan interaksi obat.
- Enzim dapat dikompartemenkan, dengan lintasan metabolisme yang berbeda-beda yang terjadi dalam kompartemen sel yang berbeda. Sebagai contoh, asam lemak disintesis oleh sekelompok enzim dalam sitosol, retikulum endoplasma, dan aparat golgi, dan digunakan oleh sekelompok enzim lainnya sebagai sumber energi dalam mitokondria melalui β-oksidasi.[63]
- Enzim dapat diregulasi oleh inhibitor dan aktivator. Contohnya, produk akhir lintasan metabolisme seringkali merupakan inhibitor enzim pertama yang terlibat dalam lintasan metabolisme, sehingga ia dapat meregulasi jumlah produk akhir lintasan metabolisme tersebut. Mekanisme regulasi seperti ini disebut umpan balik negatif karena jumlah produk akhir diatur oleh konsentrasi produk itu sendiri. Mekanisme umpan balik negatif dapat secara efektif mengatur laju sintesis zat antara metabolit tergantung pada kebutuhan sel. Hal ini membantu alokasi bahan zat dan energi secara ekonomis dan menghindari pembuatan produk akhir yang berlebihan. Kontrol aksi enzimatik membantu menjaga homeostasis organisme hidup.
- Enzim dapat diregulasi melalui modifikasi pasca-translasional. Ia dapat meliputi fosforilasi, miristoilasi, dan glikosilasi. Contohnya, sebagai respon terhadap insulin, fosforilasi banyak enzim termasuk glikogen sintase membantu mengontrol sintesis ataupun degradasi glikogen dan mengijinkan sel merespon terhadap perubahan kadar gula dalam darah.[64] Contoh lain modifikasi pasca-translasional adalah pembelahan rantai polipeptida. Kimotripsin yang merupakan protease pencernaan diproduksi dalam keadaan tidak aktif sebagai kimotripsinogen di pankreas. Ia kemudian ditranspor ke dalam perut di mana ia diaktivasi. Hal ini menghalangi enzim mencerna pankreas dan jaringan lainnya sebelum ia memasuki perut. Jenis prekursor tak aktif ini dikenal sebagai zimogen.
- Beberapa enzim dapat menjadi aktif ketika berada pada lingkungan yang berbeda. Contohnya, hemaglutinin pada virus influenza menjadi aktif dikarenakan kondisi asam lingkungan. Hal ini terjadi ketika virus terbawa ke dalam sel inang dan memasuki lisosom.[65]
[sunting] Keterlibatan dalam penyakit
Oleh karena kontrol aktivitas enzim yang ketat diperlukan untuk menjaga
homeostasis, malafungsi (mutasi, kelebihan produksi, kekurangan produksi ataupun delesi) enzim tunggal yang penting dapat menyebabkan
penyakit genetik. Pentingnya enzim ditunjukkan oleh fakta bahwa penyakit-penyakit mematikan dapat disebabkan oleh hanya mala fungsi satu enzim dari ribuan enzim yang ada dalam tubuh kita.
Salah satu contohnya adalah
fenilketonuria. Mutasi asam amino tunggal pada enzim
fenilalania hidroksilase yang mengatalisis langkah pertama degradasi
fenilalanina mengakibatkan penumpukkan fenilalanina dan senyawa terkait. Hal ini dapat menyebabkan
keterbelakangan mental jika ia tidak diobati.
[66]
Contoh lainnya adalah mutasi silsilah nutfah (
germline mutation) pada gen yang mengkode enzim
reparasi DNA. Ia dapat menyebakan sindrom penyakit kanker keturunan seperti
xeroderma pigmentosum. Kerusakan ada enzim ini dapat menyebabkan kanker karena kemampuan tubuh memperbaiki mutasi pada genom menjadi berkurang. Hal ini menyebabkan akumulasi mutasi dan mengakibatkan berkembangnya berbagai jenis kanker pada penderita.













 (dalam jaringan tubuh; konsentrasi CO2 yang tinggi)
(dalam jaringan tubuh; konsentrasi CO2 yang tinggi) (pada
(pada 








